MÄÄRATLUS
Elektrooniline valem Keemilise elemendi aatomi (konfiguratsioon) näitab elektronide paigutust aatomis või molekulis elektronkihtidel (tasanditel ja alamtasanditel).
Kõige sagedamini kirjutatakse elektroonilised valemid maa- või ergastatud aatomite ja ioonide jaoks.
Keemilise elemendi aatomi elektroonilise valemi koostamisel tuleb arvestada mitmete reeglitega. Need on Pauli printsiip, Klechkovski reeglid või Hundi reegel.
Elektroonilise valemi koostamisel tuleb arvestada, et keemilise elemendi perioodi number määrab ära energiatasemete (kestade) arvu aatomis ja selle järjekorranumber elektronide arvu.
Vastavalt Kletškovski reegel, täidetakse energiatasemed põhi- ja orbitaalkvantarvude summa (n + l) kasvavas järjekorras ning selle summa võrdsete väärtuste korral n kasvavas järjekorras:
1s< 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 5d ≈ 4f < 6p и т.д.
Seega vastab väärtus n + l = 5 energia alamtasanditele 3d (n = 3, l = 2), 4d (n = 4, l = 1) ja 5s (n = 5, l = 0). Esimene neist alamtasanditest täidetakse põhikvantarvu madalama väärtusega alamtasemega.
Elektronide käitumine aatomites allub Šveitsi teadlase W. Pauli sõnastatud välistamisprintsiibile: aatomis ei saa olla kahte elektroni, millel oleks samad kõik neli kvantarvu. Vastavalt Pauli põhimõte, ühel orbitaalil, mida iseloomustavad kolme kvantarvu (põhi-, orbitaal- ja magnetarvu) teatud väärtused, võib olla ainult kaks elektroni, mis erinevad spin-kvantarvu väärtuse poolest. See tuleneb Pauli põhimõttest tagajärg: maksimaalne võimalik elektronide arv igal energiatasemel on põhikvantarvu kaks korda suurem.
Aatomi elektrooniline valem
Aatomi elektrooniline valem on kujutatud järgmiselt: iga energiatase vastab teatud põhikvantarvule n, mida tähistatakse araabia numbriga; igale numbrile järgneb energia alamtasemele vastav täht, mis tähistab orbitaalkvantarvu. Tähe kõrval olev ülaindeks näitab elektronide arvu alamtasandil. Näiteks naatriumi aatomi elektrooniline valem on:
11 N 1s 2 2s 2 2p 6 3s 1 .
Energia alamtasandite täitmisel elektronidega tuleb ka jälgida hundi reegel: sellel alamtasandil kipuvad elektronid hõivama energia olekuid nii, et koguspinn on maksimaalne (see peegeldub kõige selgemini elektrongraafiliste valemite koostamisel).
Näited probleemide lahendamisest
NÄIDE 1
| Harjutus | Kirjutage üles aatomnumbritega 7, 16, 21 elementide aatomite elektroonilised valemid. |
| Vastus | Keemiline element aatomnumbriga 7 on lämmastik. See on teises perioodis, seega on sellel kaks orbitaali. Lämmastiku asukoht perioodilise tabeli V rühmas näitab 5-valentssete elektronide olemasolu välisenergia tasemel: 1s 2 2s 2 2p 3 . Keemiline element aatomnumbriga 16 on väävel. See on kolmandas perioodis, seega on sellel kolm orbitaali. Väävli asukoht perioodilise tabeli VI rühmas näitab 6 valentselektroni olemasolu välisenergia tasemel: 16 S) 2) 8) 6 ; 1 s 2 2 2 2 p 6 3 s 2 3 p 4 . Keemiline element aatomnumbriga 21 on skandium. See on neljandas perioodis, seega on sellel neli orbitaali. Skandiumi asukoht perioodilise tabeli III rühmas näitab 3 valentselektroni olemasolu välisenergia tasemel: 21 Sc) 2) 8) 8) 3 ; 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 p 2 4 s 2 . |
kvantarvud
n- peamine kvantarv, see määrab elektronide energia ja elektronpilve suuruse, võtab täisarvulisi väärtusi. elektronid samaga n moodustavad energiataseme. (n = perioodi number perioodilisuse tabelis)
L– orbitaali kvantarv määrab orbitaali kuju ja võtab väärtuse vahemikus 0 kuni n-1
n= 1, L= 0 – S-orbitaal (kuul)
n = 2, L = 0; 1 – S ja P – orbitaal (hantel)
n = 3, L = 0; 1 ; 2 - S, P ja d - orbitaal (keeruline kroonlehe kuju) (L = 0 - S orbitaal, L = 1 - P orbitaal, L = 2 - d orbitaal)
n = 4, L = 0; 1 ; 2; 3 (F - orb. veelgi keerulisem)
m- magnetkvantarv, määrab orbitaali ruumilise orientatsiooni, võtab väärtuse - L kuni + L. L=0 m=0 1(üks) S-orbitaal L=1 m= -1;0;1 3 P-orbitaali L=2 m=-2,-1,0,1,2 5 d-orb. jne.
- spin-kvantarv, mis iseloomustab elektroni liikumist ümber oma telje ja sellel on 2 orientatsiooni: "paremale", "vasakule" = + või -
4 kvantarvu abil saab kirjeldada mis tahes elektroni olekut vaakumis, selleks moodustavad nad aatomite elektroonilised valemid.
Elementide aatomite elektrooniliste valemite koostamise reeglid
1. Väikseima energiatarbimise põhimõte: Elektronid asuvad aatomi nendel orbitaalidel, mida iseloomustab madalaim energia. (Kletškovski reegel) Väikseima kvantarvuga orbitaal ( n+L), Kui ( n+L) orbitaalid on võrdsed, madalaima energiaga on vähem n.
2. Pauli põhimõte: aatomil ei saa olla 2 elektroni, millel on sama kogum kõigist 4 kvantarvust, mis tähendab, et ühele orbitaalile mahub ainult 2 antiparalleelsete spinnidega elektroni.
S alamtase - 1 orbitaal 2e
P alamtase - 3 orbitaali 6e
d alamtase - 5 orbitaali 10e
f alamtase - 7 orbitaali 14e
3. Hundi reegel: summaarne spinni arv alamtasandil peaks olema maksimaalne, st kui alamtase on täidetud, istub esmalt üks elektron igal orbitaalil ja kõigil on sama spinni suund (pöörlemise suund) ja kui alamtase on täidetud, istub igal orbitaalil teine elektron orbitaal juba vastupidise spinniga.
4) Perioodiline süsteem (periooditabel)
Lihtainete omadused, aga ka elementide ühendite vormid ja omadused on perioodilises sõltuvuses tuuma laengust ja elemendi aatomite elektroonilisest konfiguratsioonist. Perioodiline süsteem on perioodilisuse seaduse graafiline esitus, see koosneb 7 perioodist (neist 3 on väikesed 1., 2. ja 3.) ja 8 rühmast.
Perioodilise seaduse füüsikaline tähendus seisneb elementide omaduste perioodilises muutumises, mis tuleneb aatomite sarnaste elektronkihtide perioodilisest uuendamisest koos põhikvantarvu suurenemisega. n
(n = perioodi number)
Rühmad sisaldavad elemente, millel on perioodiliselt korduv välise energiataseme elektrooniline struktuur ja sarnased omadused.
Näiteks: I-gr, A-subgr. :
Na 3s - need on kõik leelismetallid,
K 4s on neil sama väline struktuur
Rb 5s Energet. tase s
Cs 6s Metalli aktiivsus suureneb
Fr 7s alla
Iga periood (v.a 1.) algab kahe s-elemendiga, lõpeb kuue elemendiga ja väikestel perioodidel muutuvad elementide omadused dramaatiliselt.
Tabeli järgi allapoole metallilised omadused suurenevad ehk elektronid eraldatakse tabeli järgi kergemini. paremal met. pühakuid väheneb.
IV perioodil esineb s- ja p-elementide vahel 10 d-elementi ning VI ja VII perioodil f-elemente.
Elementide aatomite elektrooniline struktuur ja nende asukoht perioodilises süsteemis on omavahel tihedalt seotud.
1) Selle tuuma elemendi seerianumber \u003d Z (laeng) ja elektronide arv aatomi elektroonilises struktuuris.
Näiteks: Z=30(Zn), 30e; 1s,2s,2p,3s,3p,3d,4s (d-element)
2) Iga periood algab uue energiataseme täitmisega, seega nr rada. = välise energiataseme peamine kvantarv aatomi elektronstruktuuris. 4s (Zn)-IV periood
3) nr gr. langeb kokku valentselektronide arvuga aatomites.
5) Elementide aatomite perioodiliselt muutuvad omadused:
1. Aatomite raadiused: aatomil ei ole laine liikumise tõttu selgeid piire. elektron. Aatomi orbitaalraadius )≈ teoreetiliselt arvutatud kaugus aatomituumast välise elektronpilve peamise maksimaalse tiheduseni. Sagedamini kasutatakse aatomite efektiivseid raadiusi ((need on tuumadevahelised kaugused molekulides).
Metallelementide ja mittemetalliliste (eriti gaaside) puhul erinevad need oluliselt.
Punktides (vasakult paremale) r aatomite arv väheneb nende tuumade laengu suurenemise tõttu ja rühmades (ülevalt alla) suurenevad nad elektronikihtide arvu suurenemise tõttu, kuid see sõltuvus on aatomite struktuuriliste iseärasuste tõttu mittemonotoonne.
St-in elementide muutuste mittemonotoonsust perioodi jooksul nimetatakse sisemiseks perioodilisuseks ja rühmas sekundaarseks perioodilisuseks.
2. Ionisatsioonienergia ja elektronide afiinsus:
Ionisatsioonienergia on energia, mis on vajalik elektroni eraldamiseks neutraalsest, ergastamata aatomist.
- erutumatu energia. aatom< (при отрыве каждого последующего электрона нужно тратить все больше и больше энергии)
Ionisatsioonienergia iseloomustab elementide aatomite redutseerivaid omadusi: Mida väiksem on aatom, seda suuremad on elemendi redutseerivad omadused. sõltub elemendi tuuma aatomiraadiusest ja laengust ning elemendi aatomite elektroonilisest konfiguratsioonist. Mida väiksem on raadius ja suurem laeng, seda suurem on väärtus.
Perioodi (vasakult paremale) väärtuses I kasvab, kuid mitte monotoonselt. Metallid I vähem kui mittemetallid.
Rühmades (ülevalt alla) väärtus üldiselt väheneb.
Elektronide afiinsuse F-energia on neutraalsele aatomile elektroni liitumise energeetiline efekt. F võib olla (+) või (-): СL+e→ (eemaldatud) He+e= = -0,22 eV (neeldunud)
F iseloomustab elementide aatomite oksüdeerivaid omadusi: mida suurem on F, seda kõrgemad on oksüdeerivad omadused. F oleneb r(aatomi raadius), Z (laeng) ja elemendi aatomite elektroonilise konfiguratsiooni kohta. Max F rühma VIIA p-elementide jaoks, Min F inertgaaside jaoks.
Elektronegatiivsus- elemendi aatomi võime tõmmata elektrone enda poole kemikaali tekkimisel. sidemed teiste elementide aatomitega. EO = 1/2 (1+F)
Perioodidel (vasakult paremale) EO üldiselt suureneb, põhialarühmades (ülevalt alla) väheneb, kuid sõltuvus ei ole monotoonne.
Keemiliste sidemete tüübid
kovalentne side– ühiste elektronpaaride moodustumise tõttu tekkiv side.
Kaheaatomilistes molekulides ( tekib mittepolaarne kovalentne side, kuna ühine elektronpaar kuulub võrdselt mõlemale aatomile. F + F → F F
Üksikkovalentne side- aatomeid ühendab üks ühine elektronpaar, kui kaks, siis side kahekordne, kui kolm siis kolmekordne. N + N → N N(paarimata elektronide arv 8-N=3, N-rühma arv)
Polaarne kovalentne side- side mittemetallide erinevate elementide (HCL, , N ) aatomite vahel
Jagatud elektronipaarid sellistes ühendites nihkuvad kõrgema elektronegatiivsusega aatomite poole.
Iooniline side- side, mis tekib ioonide vahel elektrostaatilise külgetõmbe tõttu.
Iooniline side tekib elektronegatiivsuse poolest järsult erinevate elementide aatomite vahel. Näiteks tüüpiliste vahel metallid ja tüüpilised mittemetallid (Na CL, Na, F)
Lisaks moodustub ioonside metalli- ja hapnikuaatomite vahel hapet sisaldavate hapete soolades ja leelistes.
metallist ühendus- side metallides aatomioonide vahel sotsialiseeritud elektronide abil.
Välistasandi metalliaatomid sisaldavad vähe elektrone. Need elektronid visatakse kergesti ära ja aatomid muudetakse positiivseteks ioonideks. Eraldunud elektronid liiguvad ühelt ioonilt teisele, sidudes need ühtseks tervikuks.
7) Elektrood- see on metall või muu juhtiv materjal, mis on sukeldatud selle soola (elektrolüüdi) lahusesse ja sellel toimuvat reaktsiooni nimetatakse elektroodi reaktsioon. Kui metall puutub kokku soolalahusega, liiguvad hüdraatunud ioonid metalli pinnalt lahusesse ja dehüdraatituna tagasi lahusest metalli (kristalli jõudude toimel). võre). Kui nende protsesside kiirused muutuvad võrdseks, moodustub DEL (topeltelektriline kiht) ja tekib elektroodi potentsiaal.
Elektroodi potentsiaal (𝞿 ) on elektrolüüdi ja elektroodi elektrostaatilise potentsiaali erinevus.
Elektroodipotentsiaali väärtus sõltub ainete - elektroodiprotsessis osalejate - olemusest, nende ainete kontsentratsioonist, t-st ja määratakse Nernsti võrrandiga.
Nernsti võrrand: = + ox, Punased on oksüdeerivate ja redutseerivate vormide kontsentratsioonid
on protsessis osalevate elektronide arv.
– elektroodi standardpotentsiaal (tbl. väärtus)
Metallelektroodide Nernsti võrrand: +
redokselektroodide jaoks:
vesinikelektroodi jaoks:
(tingimisi aktsepteeritud) - see on NVE (tavaline vesinikelektrood), mida võetakse erinevate elektrokeemiliste ainete elektroodide potentsiaalide võrdlemise standardina. süsteemid.
Redoksreaktsiooni toimumise tingimus:
8) Galvaaniline element- seade, milles spontaanselt toimuva oksüdatsiooni-redutseerimise reaktsiooni tõttu saadakse elektrivool. See on 2 elektroodi süsteem, mis on ühendatud vedeliku silla või poolläbilaskva vaheseinaga. Kui ühendate elektroodid metalljuhiga, siis elektronid voolavad ühelt elektroodilt (redutseerija) teisele (oksüdeerija) ja saadakse elektrivool. Chem. energia muudetakse elektriks. Oksüdeerija - suurema potentsiaaliga elektrood (katood (+)), katoodil toimuvad taastumisprotsessid.
Redutseeriv aine - väiksema väärtusega elektrood. potentsiaal (anood (-)), anoodil toimuvad oksüdatsiooniprotsessid.
Aku on pöörduv keemiline vooluallikas, seda saab laadida ja korduvalt kasutada.
Näiteks pliiaku (happe)- koosneb elektroodidest (positiivsed ja negatiivsed) ja elektrolüüdist.
1. elektrood - plii, 2. elektrood - pliidioksiid, elektrolüüt 30% väävelhape.
Toimimispõhimõte põhineb plii ja pliidoksiidi elektrokeemilistel reaktsioonidel väävelhappe vesilahuses.
Üldine aku võrrand:
9) elektrolüüs - redoksprotsess, mis toimub elektroodidel, kui vool läbib elektrolüüti.
2 elektroodi lastakse elektrolüüdiga täidetud elektrolüütivanni ja ühendatakse vooluallikaga. Vooluallikas pumpab elektrone ühelt elektroodilt teisele. Elektrood, millelt elektronid eemaldatakse, omandab + laengu (anood), mis võtab vastu elektronide (-) laengu (katood).
Elektrolüüsi käigus toimuvad protsessid on määratud elektrolüüdi, lahusti ja elektroodi materjali omadustega. (Kui elektrolüüs toimub vesilahuses, saab H2O molekule redutseerida ja oksüdeerida katoodil ja anoodil.
Katood: 2H2O + 2e = 2 OH
Anood: A2H2O - 4e \u003d O2 + 4H
Kui on võimalikud mitmed reaktsioonid, läheb esimesena edasi see, mis nõuab kõige vähem energiat.
inertne nimetatakse elektroodiks, mille materjal elektrolüüsi käigus ei oksüdeeru.
Anoodi enda materjali saab anoodil oksüdeerida, näiteks kui anood on valmistatud Ni-st, Cu-st, Cd-st, Pb-st jne. Selliseid anoode nimetatakse lahustuvateks.
Metallide rafineerimiseks kasutatakse lahustuva anoodi meetodit. Anood on valmistatud mustast metallist.
10) Elektrokeemiline polarisatsioon- elektroodi reaktsiooni potentsiaali tasakaalust kõrvalekaldumise nähtus. ülepinge- väärtus, mille võrra hälve on ɳ (see).
Polarisatsiooni tekkimine on seotud elektrokeemilise protsessi üksikute etappide aeglusega. Polarisatsioon on eriti suur gaaside O2, H2 eraldumise ajal. Elektroodi polarisatsioon sõltub elektroodi materjalist, seda suurem on voolutihedus i=I/S (I on elektroodi läbiv vool, S on elektroodi pindala). Polarisatsioonikõver on elektroodi potentsiaali sõltuvus voolutihedusest.
– Polarisatsiooni hulk.
11) Faraday seadused: 1. seadus: Elektrolüüsi käigus moodustunud aine mass on võrdeline elektrolüüdi läbinud elektrihulgaga. = K*Q kus: Q- elektrienergia kogus, Q=I*t, kus: I-vool, t-aeg.
K = kus: E on ekvivalentmass E = kus: M on mool (aine molaarmass), n on oksüdatsiooni või redutseerimise käigus liikunud elektronide arv, F on Faraday arv = 26,8 A või 96500 K / mol .
2. seadus: Kui sama kogus elektrit läbib erinevaid elektrolüüte, on samanimelistele elektroodidele eralduvate ainete massid võrdelised nende ekvivalentmassidega.
Kasutamine elektrokeemilistes protsessides: 1) G.E põhimõtet kasutatakse autonoomsetes toiteallikates. On primaarne ja sekundaarne. Esmane- on pöördumatud, ei saa pärast aktiivse aine (patareide) tarbimist tööseisundisse naasta. Sekundaarne– saab regenereerida, suunates voolu vastupidises suunas (patareid).
Elektrolüüsi kasutatakse tööstuses: leeliste ja muude ainete tootmiseks., paljude metallide tootmiseks - AL, Mg, Na, Cd., Me puhastamiseks (rafineerimiseks) kasutatakse saastunud Me, anoodina (Cu, Ni, Pb) , seda kasutatakse galvaniseerimisel.
galvaniseerimine- muude metallide kihtide metalltoodete pinnale kandmise protsess, seda tehakse korrosiooni eest kaitsmiseks ja ilu huvides.
Elektrotüüp- saada trükiseid, toodete koopiaid, näiteks tüpograafiliste klišeede jaoks.
13) Metallide füüsikalised omadused. Metalliline läige, kõrge elektrijuhtivus, soojusjuhtivus, plastilisus, elastsus. Need omadused on määratud liikuvate elektronide ja metallide sidemete olemasoluga metallides.
Metallide olemuse, nende struktuuri erinevus toob kaasa mõningate füüsikaliste omaduste erinevuse. Leeliselised (Li, Na, K, Rb, Cs) madala tihendustihedusega ja väikese laenguga on pehmed ja d-metallid (Cr) on väga kõvad. Sulamistemperatuuri erinevus on suur, alates 28 °C (Cs) kuni 3370 °C (W).
12) Metallide asend perioodilisuse süsteemis.
Metalli klassifikatsioon
passiivne (Cu-Au jne...)
Metallkristallide omadused: metalliaatomid reastuvad kristallvõredesse
Kristallvõrede tüübid: Kerekeskne (kuubik), näo keskel (kuubik), kõige tihedam kuusnurkne.
Aatomite struktuuri tunnused: välisenergia tasemel väike hulk elektrone.
Metallide saamise meetodid: 1. Metalthermy- maakide taaskasutamine alumiiniumi, magneesiumi ja muude metallide abil
2.Pürometallurgia– maakide redutseerimine kivisöe, CO abil, kõrge t juures:
+ → 2 Fe + 3 (temperatuuril)
3.Elektrolüüs: a) Cu (Cu - katood, CL - anood)
b) 2NaCL → 2Na + (2Na on katood,
4.Hüdrometallurgiline meetod- hõlmab sageli ka metallide saamise etappi elektrokeemilise redutseerimise teel.
2ZnS + 3 (sulfiidmaakide töötlemisel esimesed sulfiidid
kõrge t juures muudetakse oksiidideks.)
2Zn + 2 (2Zn on katood, )
Kaasaegsed tehnoloogiad on suunatud kõrge puhtusastmega metallide saamiseks (tsoonisulatus, elektronkiirte sulatamine jne).
14) Metallide keemilised omadused. Vastavalt chem. Saint-you metallid on redutseerivad ained ja reageerivad oksüdeerivate ainetega.
Perioodil. Enamik süsteemi elemente on metallid. Metallid hõlmavad kõiki s,d,f-elemente (v.a He) ja ka p-elemente. P-elementide hulka kuuluvad elemendid III A gr - AL, Ga, In, IV A gr - Ge, Sn, Pb, V A gr Sb, Bi ja VI A - Po (poloonium).
Metalli klassifikatsioon: 1. Elektroonilise struktuuri järgi: s, p, d ja f - metallid.
2. Vähendades aktiivsust: aktiivne (Li-AL) (vastavalt mitmele pingele), keskmine (AL-H),
passiivne (Cu-Au jne...)
Vabade metalliaatomite redutseerivat aktiivsust iseloomustab ionisatsioonienergia (). Mida väiksem, seda suurem on taastamisvara. metallist. In gr. A, (s- ja p-metallide puhul) vähendav vara. kasvab ülalt alla ja gr. B (d-metallide puhul) - väheneb.
lahendustes metalliaatomite redutseerivat aktiivsust iseloomustab elektroodipotentsiaali väärtus (). Mida negatiivsem, seda suurem on taastumine. aktiivsed .. Kõige aktiivsemad redutseerijad on leelismetallid.
1) Metallid reageerivad intensiivselt lihtsate ainetega, halogeenid (fluor, kloor, broom, jood), väävel, vesinik.
Hapnikuga: Enamik metalle oksüdeeruvad õhus, muutudes kaetud oksiidkilega, kui kile on tihe, kaitseb see metalli korrosiooni eest. Kõik leelismetallid: Li, Na, K jne. reageerivad aktiivselt hapnikuga, Rb, Cs - süttivad iseeneslikult.
Klooriga: reageerige jõuliselt (Mg+ =Mg)
Halliga: vähem jõuline (kuumutamisel) (Fe+S→FeS raudsulfiid)
Vesinikuga: reageerivad ainult leelis- ja leelismuldmetallid. (2Li+ =2LiH) (Ca+)
2) Reaktsioonid veega: Me + metallid reageerivad, kui nende elektroodi potentsiaal on madalam kui vesinikul (alla 0), nad reageerivad nihutades . Näiteks: -2,714v, seega 2Na+
Kui metalli pinnal on oksiidkile, toimub koostoime veega kuumutamisel.
3) Reaktsioonid soolalahustega: metallid reageerivad soolalahustega, tõrjudes neist välja vähemaktiivse metalli:
() Cu\u003d 0,337 V, () / Ni \u003d - 0,25 V
4)Reaktsioonid leelistega: reaktsioonid kulgevad evolutsiooni käigus, elektroodi potentsiaal peab olema, metallil peab olema oksiidide ja hüdroksiidide amfoteersus (need on AL, Zn, Cr, Be jne)
5) Reaktsioonid hapetega: metallide vastastikmõju hapetega sõltub metalli aktiivsusest, to-you kontsentratsioonist ja t.
HCL interakteerub ainult metallidega, milles vesiniku vabanemisel peab metallkloriid olema vees lahustuv.
(lahjendatud väävelhape reageerib metallidega samamoodi nagu vesinikkloriidhape: Zn +
Kontsentreeritud väävelhape oksüdeerib metalle tänu sulfaadioonidele () redutseerimisproduktid sõltuvad metalli aktiivsusest. kuni Mg + (aktiivne taastamine , keskmine kuni , passiivne .
Väävelhape passiveerib metalle: Fe, Co, Ni, Cr, AL, Be. (nende metallidega toimub reaktsioon ainult kuumutamisel).
Vask reageerib kontsentreeritud väävelhappega
Reaktsioon lahjendatud lämmastikhappega. Lahjendatud lämmastik. See on tugevam oksüdeerija kui väävel, oksüdeerib toatemperatuuril enamiku metalle. Seda redutseeritakse aktiivsete metallidega kuni , keskmise aktiivsusega metallidega kuni või , mitteaktiivsete kuni -NO-ni.
Kontsentreeritud lämmastikhape redutseeritakse enamiku metallidega pruuniks gaasiks -NO ja samuti passiveerib samu metalle normaalse t juures. (Fe, Ni, Co, Cr, AL, Be)
Mitteaktiivseid d-metalle lämmastikhape ei oksüdeeri, neid saab oksüdeerida "aqua regia" + abil.
Metallide reaktsioonides mis tahes kontsentratsiooniga lämmastikhappe ja kontsentreeritud väävelhappega vesinikku ei eraldu.
Nimetatakse kirjet, mis peegeldab elektronide jaotust keemilise elemendi aatomis energiatasemete ja alamtasandite vahel elektrooniline konfiguratsioon see aatom. Aatomi põhiolekus (ergastamata) vastavad kõik elektronid minimaalse energia põhimõttele. See tähendab, et kõigepealt täidetakse alamtasandid, mille puhul:
1) Peamine kvantarv n on minimaalne;
2) Taseme sees täidetakse esmalt s-alatasand, seejärel p- ja alles siis d- (l on minimaalne);
3) Täitmine toimub nii, et (n + l) on minimaalne (Kletškovski reegel);
4) Ühe alamtasandi sees paiknevad elektronid nii, et nende summaarne spinn on maksimaalne, s.t. sisaldas kõige rohkem paarituid elektrone (Hundi reegel).
5) Elektrooniliste aatomiorbitaalide täitmisel on täidetud Pauli printsiip. Selle tagajärg on see, et energiatasemel numbriga n ei saa olla rohkem kui 2n 2 elektroni, mis paiknevad n 2 alamtasandil.
Seda järjestust kajastavate elektrooniliste valemite (või konfiguratsioonide) kirje esimene number on võrdne n, vastab sellele järgnev täht l, ja ülemine parem indeks võrdub elektronide arvuga selles olekus.
Näiteks, tseesium (Cs) on 6. perioodis, selle 55 elektroni (järjekorranumber 55) on jaotatud 6 energiataseme peale ja nende alamtasanditel, järgides orbitaalide elektronidega täitmise järjestust, saame: 55 Cs 1 s 2 2 s 2 2 lk 6 3 s 2 3 lk 6 4 s 2 4 lk 6 4 d 10 5 s 2 5 lk 6 5 d 10 6 s 1
Liitiumi elektrooniline valem omakorda - 1 s 2 2 s 1 , süsinik - 1 s 2 2 s 2 2 lk 2 , kloor - 1 s 2 2 s 2 2 lk 6 3 s 2 3 lk 5 .
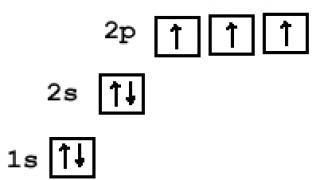
Elektronkihtide populatsiooni saab kujutada kvantrakkudena (ruudud või horisontaalsed jooned). Erinevalt elektroonilistest valemitest ei kasutata siin mitte kahte, vaid kõiki nelja kvantarvu. On näha, et elektronide energiat mitmeelektronilistes aatomites defineeritakse kvantarvuna n, ja l; elektronid erinevad väärtuste poolest ml, ja paarunud elektronide puhul on erinevad ainult spinnid. Vabad rakud tähendavad meie näites tasuta lk-orbitaalid, mis võivad aatomi ergastamisel hõivata elektrone (joonis 8).
Riis. 8. Boori elektroonilise valemi graafiline esitus.
Uurides elementide keemiliste omaduste muutumist sõltuvalt nende suhtelise aatommassi (aatommassi) väärtusest, avastas D. I. Mendelejev 1869. a. perioodilisuse seadus need omadused: Elementide omadused ja seega ka nende moodustatud lihtsate ja keerukate kehade omadused on perioodilises sõltuvuses elementide aatommassist". Kuna keemilised omadused on määratud aatomi elektronkestade struktuuriga, Mendelejevi perioodiline süsteem - see on elementide loomulik klassifikatsioon nende aatomite elektrooniliste struktuuride järgi (lisa 4). Sellise klassifikatsiooni lihtsaim alus on elektronide arv neutraalses aatomis, mis võrdub tuuma laenguga. Kuid keemilise sideme moodustumisel saavad elektronid aatomite vahel ümber jaotada ja tuuma laeng jääb muutumatuks, nii et perioodilise seaduse kaasaegne sõnastus on järgmine: "Elementide omadused on perioodilises sõltuvuses nende aatomite tuumade laengutest".
See asjaolu kajastub perioodilises süsteemis horisontaalsete ja vertikaalsete ridade - perioodide ja rühmade kujul.
Periood - horisontaalne rida sama arvu elektrooniliste tasemetega, perioodi number ühtib peamise kvantarvu väärtusega n välimine tase (kiht); Perioodilises süsteemis on seitse sellist perioodi. Teine ja järgnevad perioodid algavad leeliselise elemendiga ( ns 1) ja lõpeb väärisgaasiga ( ns 2 np 6).
Vertikaalselt on perioodilisustabel jagatud kaheksaks rühmaks, mis jagunevad peamine - A , koosnevad s- Ja lk-elemendid ja pool - B-alarühmad sisaldavad d-elemendid. III B alagrupp, v.a d-elemendid, sisaldab 14 4 f- ja 5 f-elemendid (pered 4 f-lantaniidid ja 5 f-aktiniidid). Peamised alarühmad sisaldavad välisel elektronkihil sama arvu elektrone, mis on võrdne rühma arvuga. Peamistes alarühmades asuvad valentselektronid (elektronid, mis on võimelised moodustama keemilisi sidemeid) s- Ja lk-välise energiataseme orbitaalid, küljel - sees s-orbitaalid välis- ja d-eelvälise kihi orbitaalid. Sest f-elemendid on valents ( n – 2)f- (n – 1)d- Ja ns-elektronid. Elementide sarnasus igas rühmas on perioodilisuse tabeli kõige olulisem muster. Lisaks tuleb märkida, et diagonaalne sarnasus elementide paaridele Li ja Mg, Be ja Al, B ja Si jne. See muster on tingitud kalduvusest muuta omadusi vertikaalselt (rühmades) ja nende muutumisest horisontaalselt (perioodides).
Elemendi aatomite elektronkihi struktuur muutub perioodiliselt ühelt poolt elemendi järjekorranumbri suurenemisega ja teisest küljest määrab omadused elektronkihi struktuuri ja seetõttu on nad perioodilises sõltuvuses aatomituuma laengust.
Aatomikarakteristikute perioodilisus
Elementide aatomite keemiliste omaduste muutumise perioodilisus sõltub sellest muutused aatomi ja iooni raadiuses.
Väliste elektronkihtide peamise maksimaalse tiheduse asukohta võetakse vaba aatomi raadiuseks. See nn orbiidi raadius . Kui arvestada aatomiraadiuste suhtelisi väärtusi, on lihtne tuvastada nende sõltuvuse perioodilisust elemendi arvust.
Perioodidel orbiidi aatomiraadiused tuumalaengu suurenedes Züldiselt väheneb monotoonselt väliste elektronide tuumaga interaktsiooni astme suurenemise tõttu. Alarühmades raadiused suurenevad peamiselt elektronkihtide arvu suurenemise tõttu.
Kell s- Ja lk-elemendid on raadiuste muutus nii perioodides kui ka alarühmades tugevam kui d- Ja f-elemendid, kuna d- Ja f elektronid on sisemised. Raadiuste vähendamine d- ja f-elemendid perioodides nimetatakse d - Jaf - kokkusurumine. Tagajärg f-kompressioon on see, et elektrooniliste vastete aatomiraadiused d-viienda ja kuuenda perioodi elemendid on peaaegu samad.
Neid elemente nimetatakse nende omaduste läheduse tõttu kaksikelementideks.
Ioonide moodustumine toob kaasa ioonide raadiuse muutumise võrreldes aatomitega. Sel juhul on katioonide raadiused alati väiksemad ja anioonide raadiused on alati suuremad kui vastavad aatomiraadiused.
Aatomite omadusi käsitletakse kui võimet anda või vastu võtta elektrone, mis on tingitud aatomite soovist omandada stabiilne elektrooniline konfiguratsioon, mis on sarnane inertgaasidele. Metallilisi omadusi peetakse elemendi aatomite võimeks loovutada elektrone ja avaldada redutseerivaid omadusi, samas kui mittemetallilisi omadusi peetakse elektronide vastuvõtmiseks ja oksüdeerivateks omadusteks.
Ionisatsioonienergia aatom I on energia, mis on vajalik neutraalse aatomi muundamiseks positiivselt laetud iooniks. Selle väärtus sõltub tuuma laengu väärtusest, aatomi raadiusest ja elektronide vastastikusest mõjust. Ionisatsioonienergiat väljendatakse kJ∙mol –1 või eV. Keemiauuringute jaoks on kõige olulisem ionisatsioonipotentsiaal esimest järku on energia, mis kulub nõrgalt seotud elektroni täielikule eemaldamisele ergastamata olekus olevast aatomist.
E o - e- \u003d E +, I 1 – esimene ionisatsioonipotentsiaal;
E + - e- \u003d E 2+, I 2 - teine ionisatsioonipotentsiaal jne. I 1 < I 2 < I 3 < I 4 ...
Ionisatsioonienergia määrab keemilise sideme olemuse ja tugevuse ning taastav elementide omadused (tabel 28).
Algoritm elemendi elektroonilise valemi koostamiseks:
1. Määrake elektronide arv aatomis, kasutades keemiliste elementide perioodilist tabelit D.I. Mendelejev.
2. Määrake selle perioodi numbri järgi, milles element asub, energiatasemete arv; elektronide arv viimasel elektroonilisel tasemel vastab rühmanumbrile.
3. Jagage nivood alamtasanditeks ja orbitaalideks ning täitke need elektronidega vastavalt orbitaalide täitmise reeglitele:
Tuleb meeles pidada, et esimesel tasemel on maksimaalselt 2 elektroni. 1s2, teisel - maksimaalselt 8 (kaks s ja kuus R: 2s 2 2p 6), kolmandal - maksimaalselt 18 (kaks s, kuus lk ja kümme d: 3s 2 3p 6 3p 10).
- Peamine kvantarv n peaks olema minimaalne.
- Esmalt täidetud s- alamtasand siis p-, d-b f- alamtasandid.
- Elektronid täidavad orbitaale orbiidi energia kasvavas järjekorras (Kletškovski reegel).
- Alamtasandi sees hõivavad elektronid esmalt ükshaaval vabad orbitaalid ja alles pärast seda moodustavad paarid (Hundi reegel).
- Ühel orbitaalil ei saa olla rohkem kui kaks elektroni (Pauli põhimõte).
Näited.
1. Koostage lämmastiku elektrooniline valem. Lämmastik on perioodilisuse tabeli number 7.

2. Koostage argooni elektrooniline valem. Perioodilises tabelis on argoon number 18.
1 s 2 2 2 2 p 6 3 s 2 3 p 6.

3. Koostage kroomi elektrooniline valem. Perioodilises tabelis on kroom number 24.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5

Tsingi energiadiagramm.
4. Koostage tsingi elektrooniline valem. Perioodilises tabelis on tsink number 30.
1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 p 10
Pange tähele, et osa elektroonilisest valemist, nimelt 1s 2 2s 2 2p 6 3s 2 3p 6, on argooni elektrooniline valem.
Tsingi elektroonilist valemit saab esitada järgmiselt.
Paljud metallid on looduses tavalised mitte ainult mitmesuguste kivimite või mineraalide koostises, vaid ka vabal kujul. Näiteks kuld, hõbe ja vask. Aktiivsed metallilised elemendid nagu naatrium, mille elektrongraafilist valemit me uurime, ei esine aga lihtsa ainena. Põhjuseks on nende kõrge reaktsioonivõime, mis põhjustab aine kiiret oksüdeerumist õhuhapniku toimel. Seetõttu hoitakse metalli laboris petrooleumi või tööstusliku õli kihi all. Kõigi leelismetallielementide keemilist aktiivsust saab seletada nende aatomite struktuuriliste iseärasustega. Vaatleme naatriumi elektrongraafilist valemit ja uurime, kuidas selle omadused mõjutavad füüsikalisi omadusi ja koostoimet teiste ainetega.
naatriumi aatom
Perioodilise süsteemi esimese rühma põhialarühma elemendi asukoht mõjutab selle elektriliselt neutraalse osakese struktuuri. See diagramm illustreerib elektronide paigutust aatomi tuuma ümber ja määrab selles olevate energiatasemete arvu:
Prootonite, neutronite ja elektronide arv naatriumi aatomis on vastavalt 11, 12, 11. Prootonite arv ja elektronide arv määratakse elemendi seerianumbri järgi ning neutraalsete tuumaosakeste arv on võrdne nukleoniarvu (aatommassi) ja prootoniarvu (järjekorranumber ) erinevusele. Negatiivselt laetud osakeste jaotuse registreerimiseks aatomis saate kasutada järgmist elektroonilist valemit: 1s 2 2s 2 2p 6 3s 1.
Aatomi ehituse seos aine omadustega
Naatriumi kui leelismetalli omadused on seletatavad sellega, et ta kuulub s-elementide hulka, selle valents on 1 ja oksüdatsiooniaste on +1. Üks paaritu elektron kolmandal, viimasel, kihil määrab selle redutseerimisomadused. Reaktsioonides teiste aatomitega loovutab naatrium alati oma negatiivse osakese elektronegatiivsematele elementidele. Näiteks õhuhapniku toimel oksüdeerides muutuvad Na aatomid positiivselt laetud osakesteks - katioonideks, mis on osa oksiidi põhimolekulist Na 2 O. Sellel reaktsioonil on järgmine vorm:
4Na + O2 \u003d 2Na2O.

Füüsikalised omadused
Naatriumi elektrongraafiline valem ja selle kristallvõre määravad sellised elemendi parameetrid nagu agregatsiooni olek, sulamis- ja keemistemperatuur, samuti soojuse ja elektrivoolu juhtimise võime. Naatrium on kerge (tihedus 0,97 g/cm3) ja väga pehme hõbedane metall. Vabalt liikuvate elektronide olemasolu kristallvõres põhjustab kõrget soojus- ja elektrijuhtivust. Seda esineb looduslikult mineraalides, nagu keedusool NaCl ja silviniit NaCl × KCl. Naatrium on väga levinud mitte ainult elutus looduses, näiteks merede ja ookeanide kivisoolade või merevee koostises. Ta on koos kloori, väävli, kaltsiumi, fosfori ja muude elementidega kümne kõige olulisema organogeense keemilise elemendi hulgas, mis moodustavad elusaid bioloogilisi süsteeme.
Keemiliste omaduste tunnused
Naatriumi elektrongraafiline valem näitab selgelt, et ainus Na-aatomi viimasel, kolmandal energiakihil pöörlev s-elektron on nõrgalt seotud positiivselt laetud tuumaga. See väljub kergesti aatomi piiridest, naatrium reageerides hapniku, vee, vesiniku ja lämmastikuga käitub tugeva redutseerijana. Siin on leelismetallide tüüpiliste reaktsioonivõrrandite näited:
2Na + H2 \u003d 2NaH;
6Na + N2 \u003d 2Na3N;
2Na + 2H2O \u003d 2NaOH + H2.

Reaktsioon veega lõpeb keemiliselt agressiivsete ühendite - leeliste moodustumisega. Naatriumhüdroksiidil, mida nimetatakse ka, on aktiivsete aluste omadused ja tahkes olekus on seda kasutatud gaaside kuivatusainena. Naatriummetalli toodetakse tööstuses soolasulami - naatriumkloriidi või vastava hüdroksiidi elektrolüüsil, samal ajal kui katoodile tekib naatriummetalli kiht.
Oma artiklis uurisime naatriumi elektroonilist graafilist valemit ning uurisime ka selle omadusi ja tootmist tööstuses.